近日,“神经纤维瘤患儿妈妈为陪读考下教资”、“广州半岁神经纤维瘤患儿跨省进京求医”两起新闻事件引起关注,并一度冲上热搜。危及患儿生命的神经纤维瘤病究竟是一种什么样的疾病,发病率如何,诊断路径是否明确,是否有药可治?首都医科大学附属北京儿童医院耳鼻咽喉头颈外科主任医师王生才强调,神经纤维瘤病诊疗路径明确,尽早诊断、尽早干预,对疾病控制及改善生活质量至关重要。
8月11日,“罕见病患儿妈妈为陪读考下教资”一事受到关注并引发热搜。据媒体报道,2015年刚满10个月确诊神经纤维瘤病的武汉男孩满满,曾被医生判断活不过3岁。今年8月10日,他度过了9岁生日,妈妈邹杨在社交平台为儿子例行打卡称“满满出生已经3590天。为了陪儿子上学,妈妈一路考下幼师和小学教师资格证,还带着满满旅游,成为志愿者,帮助有相似情况的家庭。
在另一起热点事件中,神经纤维瘤患儿坐着救护车跨省进京求医也曾引发各大媒体关注。据多家媒体8月5日报道,广州半岁男孩因患有Ⅰ型神经纤维瘤病中最典型的丛状神经纤维瘤病(NF1-PN),鼻子、颈部、胸部多处长了神经纤维瘤,并出现呼吸衰竭,当地医院的治疗未能从根源上解决问题,才有了这场跨越2000多公里的生命接力,沿途交警无缝接力护送患儿抵达北京,患儿在首都医科大学附属北京儿童医院开始了治疗。
折磨两个孩子的罕见遗传性疾病——神经纤维瘤病,也因此进入公众视野。
根据儿童及青少年神经纤维瘤病诊疗规范(2021年版)介绍,神经纤维瘤病是一类常染色体显性遗传性疾病,在临床和遗传学上有3种主要不同的类型:Ⅰ型神经纤维瘤病(NF1),2型神经纤维瘤病(NF2)和施万细胞瘤病(常见于成人)。其中NF1占比约98%。新生儿发病率约为1/3000。
NF1可累及全身多个系统,如皮肤、软组织、内脏、骨骼及中枢神经系统等。典型的临床表现为咖啡牛奶斑、腋窝和腹股沟雀斑、虹膜错构瘤和神经纤维瘤、骨发育不良、视路胶质瘤,还可能引发其他肿瘤和神经系统并发症。
“30%-50%的NF1患者会出现NF1-PN,可能出现在眼部、头颈部、脊椎、臀部、膀胱和肠道、腿部等多个部位,NF1-PN可因体积过大压迫临近结构。”王生才指出,NF1-PN患者瘤体逐渐增长,每年肿瘤体积增长16%左右,其中年幼患儿的进展速度更快,3-5岁患儿每年可增长35%。NF1-PN发生恶变的终身风险在8%-13%之间,恶变后五年总生存率不超过50%。NF1-PN患者具有严重的并发症,如疼痛、外貌缺陷及多种功能障碍。此外,患者终生住院率是普通人的4倍,患者疾病及经济负担严重。
2021年,NF1诊断标准加入了基因学诊断,诊断路径进一步明确。但由于疾病临床表现多样化,患者往往需经过神经内科、儿科、遗传科、眼科、神经外科、骨科、影像科、病理科、皮肤科、精神科、肿瘤科、整形外科等多学科联合诊疗后才能得到正确的诊断。
在治疗上,既往NF1以手术治疗为主,但仅有15%的肿瘤可以完全切除,且复发率高达50%以上。药物等治疗方式的作用也不容忽视。
“早期诊断、规范化治疗以及创新药物的出现,对NF1治疗思路变化及改善患儿预后意义重大。”王生才表示,目前,该疾病已有创新治疗药物纳入医保,用于治疗NF1-PN,期待各界协力提高疾病认知、提升用药“最后一公里”保障、消除歧视,为罕见病患者创造更包容关爱的未来。
新京报记者 王卡拉
校对 柳宝庆
神经纤维瘤病简介
神经纤维瘤是指神经纤维瘤病。 通常情况下,神经纤维瘤病的六大症状是皮肤症状、神经症状、眼部症状、肿瘤症状、丛状神经纤维瘤以及内脏症状。 具体分析如下:
神经纤维瘤的症状
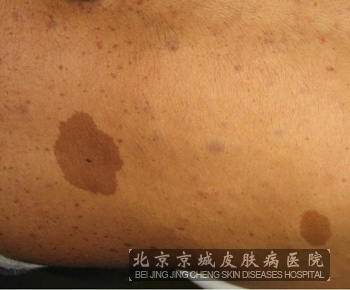
1.皮肤症状:患者出现大小不等、边缘清晰的牛奶咖啡斑疹,随年龄的增长逐渐变大,颜色由浅变深,数量增多,好发于躯干非暴露部位,形状大小不一,边缘不整齐,不会高出皮肤表面。
2.神经症状:部分患者可伴有神经系统病变,主要有由肿瘤压迫引起,表现为智能减退、记忆障碍及癫痫发作等,可合并脊柱畸形、脊髓膨胀出和脊髓空洞症,从而导致脊柱正常生理曲度改变、脊椎疼痛等症状。
3.眼部症状:患者可表现为上睑纤维软瘤、眼眶肿块、突眼搏动、眼底灰白色肿瘤,视乳

头前凸,患有视神经胶质瘤的患者还可出现突眼和视力丧失。
4.肿瘤症状:患者可能会出现各种良恶性肿瘤,如视神经胶质瘤、皮肤神经纤维瘤体等,分布于躯干、四肢等,无疼痛感,位于浅表神经的可能会出现疼痛。

5.丛状神经纤维瘤:是两个或两个以上的皮肤的神经纤维瘤,或者丛状的皮肤神经纤维瘤,表现为皮肤表面增厚、色素加深等。
6.内脏症状:生长于胸腔、纵隔、腹腔或盆腔的神经纤维瘤可引起内脏症状,其中消化道受累可引起胃肠出血或梗阻,还可引起内分泌异常。
神经纤维瘤的分型
1、神经纤维瘤1型
神经纤维瘤1型属于典型的常见神经纤维瘤,患者常常表现为皮下出现无痛性的结节,且还会伴随有牛奶咖啡斑的出现。 患者的虹膜还有可能出现淡黄色的结节,但是一般不会对患者造成不适症状,仅有少部分的神经纤维瘤1型患者出现有皮肤疼痛或智力、记忆力下降的症状。

2、神经纤维瘤2型
神经纤维瘤2型较之1型来说要严重的多,一方面,该类神经纤维瘤会对患者产生双侧的听神经瘤,导致患者出现明显耳鸣,最后可以逐渐演化成为听力下降,对患者的身体健康和生活质量有着极大的危害。 另一方面,神经纤维瘤2型一旦生长在患者的脑内,随着肿瘤生长逐渐变大,将会压迫到患者的脑内神经,使得患者的颅内压增高,出现恶心、头疼和呕吐等颅内压增高现象,还有可能会造成患者的癫痫大发作,严重时可导致患者的意识丧失、昏迷休克等,十分危险。
咖啡斑和神经纤维瘤的区别
1、患病原因不同:神经性纤维瘤是一种染色体显性遗传病,是由于基因突变、异位等缺陷导致的疾病。 发病率很低,发病率大约为1/3000~1/4000,可分为1型和2型神经纤维瘤病。 而咖啡斑则大多是遗传因素导致的,属于先天性皮肤病。
2、临床表现不同:神经性纤维瘤主要是一种突起于皮肤的肿瘤,大多分布于真皮或皮下等浅表部位,也有位于内脏和各神经系统等任意部位,为大小不一的缓慢生长的无毒性结节或肿块,部分瘤体界限不清。 而咖啡斑主要为不突起于皮肤的色素沉着,通常为淡褐色、棕褐色至暗褐色斑片,表面光滑平整,形状及数目大小不一。
3、治疗方式不同:神经纤维瘤目前主要还是采取手术切除的方式。 这种疾病无法彻底治愈,主要以缓解症状和抑制病情发展为主情发展为主。
神经性纤维瘤严重吗
神经性纤维瘤是否比较严重,要根据患者的一个症状情况来决定,在现在来讲,其实面对这种疾病,没有特效的治疗方法,手术切除治疗可以说是唯一有效的方法了。 1、神经纤维瘤病系发生于神经主干或末梢神经轴索鞘神经膜细胞及神经束膜细胞的良性肿瘤,是一种常染色体显性遗传性疾病。 2、 神经纤维瘤是基因缺陷使神经嵴细胞发育异常导致多系统损害,可归类于神经皮肤综合征。 3、 目前无特效治疗。 手术切除是治疗本病唯一有效的疗法, 部分患者可用放疗,癫痫发作者可用抗痫药治疗。 其余措施则主要是对症治疗。 4、 预防措施包括避免近亲结婚、携带者基因检测及产前诊断和选择性人工流产等,防止患儿出生。 散发者早期诊治,可延长存活期。 可以控制肿瘤细胞的转移,提高人体免疫力。 5、 能抑制肿瘤血管形成。 因为肿瘤转移和生长,依赖于自身建立一套血管系统,从人体中获取养分,来满足它快速生长需要,能抑制形成肿瘤血管的信号途径,从而控制肿瘤的生长和转移。 还能抑制肿瘤细胞生长和杀伤肿瘤细胞。
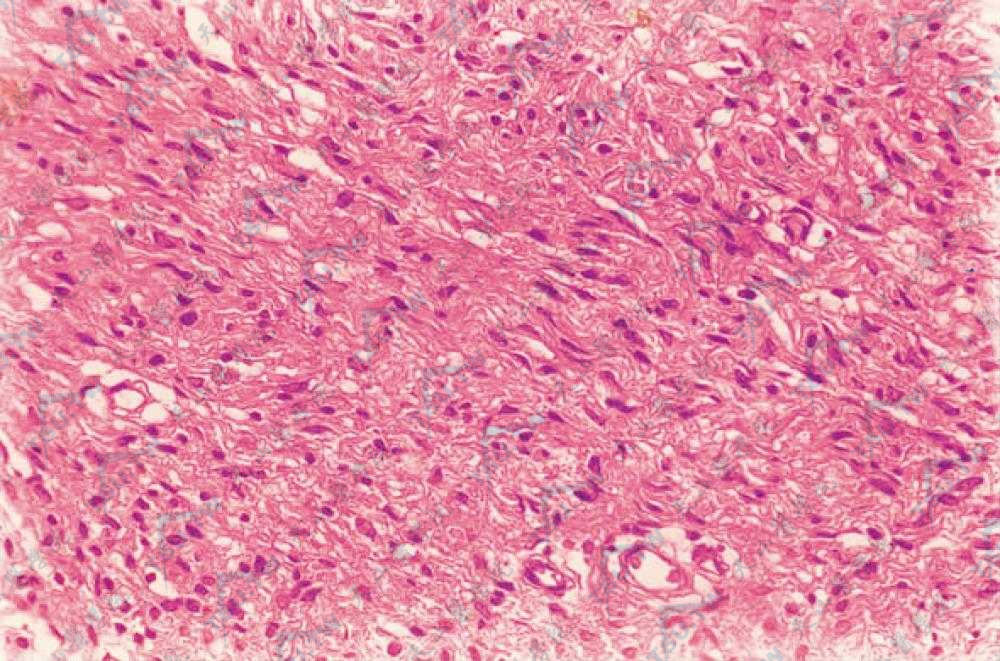
I型神经纤维瘤病患者骨骼表现
Ⅰ型神经纤维瘤病( type 1 neurofibromatosis ,NF1) 也称Von Recklinghausen 病或周围型神经纤维瘤病,是一种常染色体显性遗传性疾病,发病率为1/ 3 000~ 1/ 3 500,其中50 %来自基因突变,是突变率最高的遗传性疾病之一。 美国国立卫生研究所于1987 年提出了NF1 的临床诊断标准,具有以下2 项以上临床表现即可诊断:(1) 6 个以上咖啡牛奶斑,成人最大直径不小于15 mm ,儿童至少5 mm;(2) 2 个以上任何类型神经纤维瘤,或至少1 个丛状神经纤维瘤;(3) 腋窝或腹股沟部位色素斑;(4) 视神经胶质瘤;(5) 1 个或更多Lisch 结节(虹膜错构瘤) ;(6) 特征性骨骼改变;(7) 家族史。 NF1诊断标准之一就是特征性的骨骼病变。 一、NF1患者骨骼畸形的临床表现NF1病人发生骨骼畸形的机率为10-25%。 NF1骨骼发育不良的临床表现多样,包括脊柱侧凸、侧后凸、颈椎病变、脊椎滑脱、骨生长病变、先天性弓形变和假关节形成、骨膜下骨增生、骨皮质变薄、矮短身材和大头畸形、蝶骨翼发育不良等。 其他的骨骼畸形还有过度生长、胸廓畸形、膝内外翻、溶骨性破坏、骨硬化症、肋骨融合、髌骨缺如、并指畸形和其他先天性骨骼畸形。 1、脊柱畸形NF1最常见的表现是脊柱侧凸,大约影响10-30%的患者。 NF1 脊柱侧凸通常以胸弯为主,胸腰弯次之,腰弯和颈胸弯较少。 侧凸类型以单弯多见,双大弯次之。 临床主要有两种分类方法,按有无脊椎结构性改变可分为2 种类型:即非营养不良性脊柱侧凸和营养不良性脊柱侧凸;结合矢状面形态可分为4 种类型:(1) 矢状面形态无异常;(2) 伴有脊柱前凸;(3) 伴有弧形后凸;(4) 伴有角状后凸。 非营养不良性脊柱侧凸与特发性脊柱侧凸非常相似,而营养不良性脊柱侧凸有其非常特征性的影像学表现:(1) 肋骨铅笔样改变(最窄部分肋骨宽度小于第二肋最小直径) ;(2) Moe Nash 测量椎体旋转超过7 ;(3) 椎体后缘扇形切迹(弧形顶点到椎体后缘垂线距离在胸椎大于3 mm ,腰椎大于4 mm) ;(4) 椎体前缘扇形切迹;(5) 椎体侧方扇形切迹;(6) 冠状面或矢状面的椎体楔形变;(7) 横突梭形改变;(8) 椎弓根间距增大;(9) 椎间孔扩大。 上述改变中以肋骨铅笔样改变、椎体旋转和椎体后缘扇形切迹最常见。 营养不良性脊柱侧凸通常发病早、进展快,常累及5个以下的椎体,治疗困难。 对于治疗营养不良性脊柱侧凸时常见的并发症包括椎体质软,强度差,病人固定术后侧凸易进展,这都预示NF1病人骨质或骨量不正常。 朱锋等对NF1伴营养不良性脊柱侧凸的影像学进行分析认为NF1伴发的营养不良性脊柱侧凸与特发性脊柱侧凸之间存在有显著的影像学差异。 最常见的影像学改变为脊柱短弧形非均匀性改变100 %、脊膜扩大或椎管内膨出100 %、椎体边缘的扇贝形破坏87 %、椎管扩大85 %。 2、胫骨假关节或弓形改变NF1假关节常发生于单侧胫骨,发生率大约为3%左右。 另外有文献报道NF1患者先天性的弓形变和假关节形成发生率分别为3.5%和2%。 NF1患者胫骨典型的前外侧弓形改变容易与其他儿童轻度的胫骨外侧弓形改变鉴别。 NF1患儿通常在1岁时开始站立和行走时胫骨明显弓形变。 尽管进行了手术干预,如骨移植或带血管蒂的骨移植后,胫骨骨折后较低的愈合能力常在1岁时导致假关节形成。 长骨发育不良,主要累及胫骨,通常引起骨折和骨不连,有时需要截肢手术。 3、蝶骨发育不良NF1患者颅面部最明显的病变是蝶骨大翼单侧畸形。 通常没有症状但可以应用颅骨平片或CT诊断。 蝶骨翼骨病变在普通人群相对较少,超过50%病例与NF1相关。 发生率占NF1患者3-7%。 这些病变有时进展较快,可出现搏动性眼球突出或脑疝,但这样的并发症较少见。 NF1患儿伴有蝶骨翼病变的颅骨异常生长也可导致进行性的面部畸形。 Alwan等对3377例NF1患者进行统计分析表明蝶骨翼骨病变的发生率与长骨和椎体病变的发生率有强相关性。 他们的发现显示NF1患者典型的蝶骨翼病变与椎体和长骨的病变可能存在共同的发病机制。 4、其他骨骼发育不良长骨病变在NF1病人的发生率为1-4%,普通人群发生率为1/。 除了单侧胫骨弓形改变以外,其他长骨,包括桡骨、锁骨已有报道。 这些病变可先于确诊的指标如牛奶样咖啡斑前在婴、幼儿期出现。 影像学表现包括囊性变、骨硬化、皮质弓形变和变薄。 10岁左右出现病理性骨折,通常导致假关节形成。 由于治疗后会出现再次骨折,假关节的治疗困难。 对于受累肢体由于进行性畸形和废用性萎缩常导致截肢。 二、骨量减低或骨质疏松NF1病人骨量减少或骨质疏松的研究起于21世纪初期。 2001年,Illes和其合作者对12例NF1伴脊柱畸形的病人腰椎(L1-L4)应用双能X线骨密度仪(DXA,dual-energy X-ray absorptiometry)对骨密度(BMD,bone mineral density)测量,平均年龄19.1岁(7.6岁-42.7岁)。 发现这些病人腰椎BMD明显降低,脊柱侧凸的严重程度与腰椎骨密度Z值可能存在负相关,但没有统计学显著性差异。 Illes等对12例NF1伴脊柱畸形患者的BMD进行测量的同时,对这些患者进行血清和尿代谢产物实验检查。 但实验室检查结果没有显著发现。 另外,此研究没有年龄和性别匹配的对照组进行BMD测量。 2005年,Lammert等对104例成年NF1患者,女性66例(中位年龄41.5岁,20-80岁)男性38例,中位年龄44岁,20-75岁)的右侧跟骨应用定量超声测量仪(QUS,quantitative ultrasonometry)进行BMD测量发现NF1患者Z值低于预期的正常参考人群。 其对照性的参考数据为德国5368健康成人BMD-T值和年龄和性别校正的Z值。 另外,NF1患者Z值的分布与正常对照组相比明显降低,表明骨密度下降是NF1患者的普遍特征,而不是仅仅影响一小部分病人的单一问题。 在其研究中有2人为运动员,他们有明显增加的Z值,提示NF1患者增加体育锻炼可能明显提高BMD,从而增强治疗的效果。 对于NF1伴脊柱侧凸的需要手术治疗病人,BMD降低可能更明显。 根据年龄和性别矫正后,NF1伴脊柱侧凸且需要手术患者BMD-T值明显低于不需要手术的患者,且有统计学显著差异。 这些病人均有严重的脊柱侧凸,术前Cobb角大于50度,属于营养不良性脊柱侧凸。 33例NF1患者伴有脊柱侧凸不需要手术治疗,与60例NF1不伴有脊柱侧凸的患者BMD-Z值大致相当。 Kuorilehto等对35例NF1病人和26例正常人对行对比研究。 全部的正常对照组和26例NF1患者大于20岁。 在超过20岁的NF1患者中男14例,女12例,其中7例为绝经前患者。 轻度胸椎脊柱侧凸病人占34.3%(12/35)。 1例病人进行了脊柱侧凸矫形手术。 2例脊柱侧凸患者小于20岁。 本研究结果表明NF1男性和女性患者BMD和骨矿含量(BMC,bone mineral content)均显著降低。 与对照组相比,NF1患者骨质疏松和骨量减少的发生率明显增加。 NF1患者最低的局部BMD集中于身体的负重区,在对照组没有这种情况出现。 NF1患者的生理活动和病史不能对BMD和BMC下降做出合理解释。 这些结果提示NF1患者骨骼疾病的病理机制可能涉及骨骼系统发育障碍和骨骼结构维持损害。 但本研究没有小于20岁的正常对照组人群。 2006年,Lammert等对55例NF1患者和58例健康对照组的血清25-羟维生素D和皮肤神经纤维瘤的数量进行研究发现,NF1病人血清25-羟维生素D值明显低于正常对照组,且有统计学意义。 NF1患者血清25-羟维生素D的含量的降低可能导致BMD降低。 2007年,Stevenson等对84例NF1儿童和青少年患者(5-18岁)和293例正常对照(3-21岁)进行对比研究发现,NF1患者髋、股骨颈、腰椎和全身骨密度均有明显下降,且有统计学意义。 NF1伴有或不伴有骨骼畸形的患者骨密度比对照组显著下降,但伴有骨骼畸形的病人下降更明显。 NF1患者分成伴有骨骼畸形和不伴有骨骼畸形组。 NF1不伴有骨骼畸形组患者与对照组相比BMD显著降低。 在伴与不伴骨骼畸形两组间BMD没有统计学差异。 此研究测量青少年NF1患者的骨密度,预示其发育至成人时,容易出现骨质疏松和骨折。 尽管NF1基因灭活导致骨密度下降,但作为修饰因子的其他基因可能与体细胞突变一起引发局灶性骨骼畸形的出现。 另外,如果没有在骨骼畸形出现前的前瞻性研究资料,很难确定是否骨骼畸形引起BMD下降还是BMD下降引发骨骼畸形。 如果下降的BMD增加局部骨骼畸形的风险,临床医生应对这些病人进行早期干预。 然而,很可能由于脊柱侧凸或长骨发育不良引起患者运动下降而导致骨密度降低。 所以进一步的研究应用注意单倍体缺乏的NF1患者成骨细胞和破骨细胞的生物学功能和调节其功能的信号通路变化。 Dulai等应用DXA对23例NF1不伴有骨骼畸形的儿童和青少年患者(5-18岁)BMD进行了测量,测量部位包括全身骨密度,腰椎和股骨近端。 QUS测量双跟骨宽带超声衰减。 结果表明各组的平均BMD年龄与性别匹配的Z值均低于正常。 平均跟骨宽带超声衰减Z值也显著低于正常。 表明NF1不伴有骨骼畸形的患儿有骨量减少的趋势。 Yilmaz等对31例NF1儿童(3.1-18岁)应用DXA测量腰椎、全身、股骨近端和前臂的BMD。 11例患者有骨骼畸形,包括5例轻度侧凸的患者。 结果表明NF1患儿腰椎和股骨近端显著降低,特别是伴有骨骼畸形的患者BMD下降明显。 但NF1儿童没有明显的全身BMD降低。 另外,此研究没有年龄和性别相匹配的对照组。 2008年,Brunetti-Pierri等应用DXA分析73例非选择性NF1患者,男26例,女47例,主要是儿童和青少年(平均年龄:16.6岁,2.8-58.9岁)。 测量参数包括BMC、骨面积、BMD(全身、腰椎、粗隆和股骨颈)。 对于低骨量组,应用维生素D和钙治疗后测量钙、磷代谢、骨转化、骨密度。 结果发现平均腰椎BMD、全身骨矿含量与对照组相比,均显著降低,且有统计学意义。 54例小于20岁的NF1患者校正的BMC-Z值明显低于正常。 NF1患者骨样本组织学分析显示NF1患者由于松质骨减少骨的微结构明显改变。 本研究结果提示可能由于神经纤维瘤蛋白功能缺失而出现全身性的骨代谢障碍。 2009年,Tucker等对72例NF1成人患者BMD、18项骨代谢指标和骨折病史进行研究。 大于10%的NF1患者18项骨代谢指标中的8项超出正常参照值。 56%的NF1患者血清25-(OH)维生素D浓度降低。 34%NF1患者血清PTH浓度增加,50%的患者尿中脱氧吡啶诺林交联产物浓度增加。 NF1患者平均血清25-(OH)维生素D浓度低于正常对照组,且有统计学意义。 36例NF1患者(50%)有骨量减少,14例(19%)NF1患者有骨质疏松。 NF1患者高血清PTH浓度、高血钙浓度和高血清抗酒石酸磷酸盐浓度与BMD降低有关。 男性NF1患者更易出现BMD降低。 NF1病人病理性骨折的发生率明显增加。 其研究结果表明NF1骨代谢异常。 2010年,Seitz等对14例成年NF1患者与年龄和性别均匹配的对照组进行临床评估。 结果显示NF1患者血清25-(OH)-VD3与BMD均低于对照组。 组织形态学分析并没有提示NF1患者骨组织活检标本松质骨体积降低,但类骨质容积和成骨细胞与破骨细胞数量显著增加。 另外,qBEI(quantitative backscattered electron imaging,qBEI)分析显示NF1患者骨活检标本钙含量明显下降。 此研究结果表明NF1患者血清25-(OH)-VD3降低促进NF1患者骨骼病变发生。 明显类骨质的堆积,表明NF1患者伴有高的骨转换率,提示骨基质矿化障碍可能影响NF1患者BMD。 以上研究表明NF1患者无论成人还是青少年均存在骨量减少或骨质疏松,但其发病机制仍不明确,NF1基因编码产物神经纤维瘤蛋白可能在细胞的增殖和分化发挥重要作用。 成骨细胞和破骨细胞的功能改变,以及不同软骨细胞在软骨内成骨的过程中出现的异常可能是骨量减少或骨骼畸形改变的重要原因。






